逆转人类细胞时钟--构建人类原始生殖细胞
来自魏茨曼科学研究所和剑桥大学的研究小组联合实现了一项创举:他们在实验室中成功逆转了人类细胞的时钟,构建出了生成精子和卵子的胚胎细胞——原始生殖细胞(primordial germ cells,PGCs)。
这是第一次成功将人类细胞编程至这样的早期发育阶段。这项研究有可能帮助找到有关一些生育问题病因的答案,生成关于胚胎发育最早期的一些新见解,并有潜力在未来促使开发出新型的生殖技术。相关研究结果发表在《Cell》杂志上。
该研究的领导者、魏茨曼科学研究所分子遗传学系Jacob Hanna博士说:“多年来研究人员一直试图在培养皿中构建出人类原始生殖细胞。原始生殖细胞生成于胚胎发育的最初几个星期里,此时受精卵中的胚胎干细胞开始分化为这一非常基础的细胞类型。一旦这些原始生殖细胞变为‘特化’细胞,它们会‘几乎自发’地继续朝着精子或卵子前体细胞发育。”
2006年,诱导多能干细胞(iPS)的诞生促使科学家们提出了一个新想法:在实验室中构建这些原始生殖细胞。iPS细胞是一类外表及行为均与胚胎干细胞相似,可随后分化为所有细胞类型的“重编程”成体细胞。因此在几年前,当日本的研究人员构建出小鼠iPS细胞,随后使其分化为原始生殖细胞时,科学家们便立即着手尝试在人类细胞中重演这一成果。然而直到现在,都无人取得成功。
在以往的研究中,Hanna实验室找到了一些可以将人类细胞带至原始生殖细胞状态的新方法。这项研究将焦点放在了人类iPS细胞与小鼠胚胎细胞的区别上:在实验室中易于将小鼠胚胎细胞维持在干细胞状态,而在插入4个基因重编程的人类iPS细胞后,发挥着强大的驱动力,使细胞发生分化,而且它们往往保留了一些“初始”的痕迹。
Hanna和他的研究小组随后建立了一种方法来下调分化遗传信号通路,由此构建出了一种新型的iPS细胞,他们将之命名为“原始细胞”。这些原始细胞似乎让iPS细胞更进一步恢复了青春,更接近于能够真正分化为所有细胞类型的原始胚胎状态。由于这些原始细胞与它们的小鼠对应物更加相似,Hanna和研究小组认为可以将它们诱导分化为原始生殖细胞。
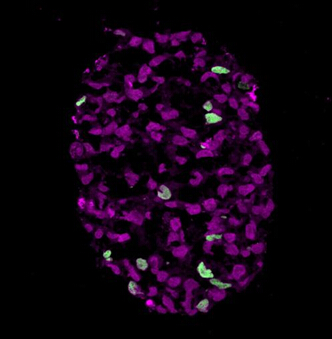
将在小鼠细胞实验中取得成功的一些技术,应用于原始人类胚胎干细胞和iPS细胞,该研究小组设法在两种情况下均生成了与人类原始生殖细胞看起来完全相同的细胞。和剑桥大学的Azim Surani教授实验室研究小组一起,科学家们进一步在两个实验室中联合测试和优化了这一方法。通过添加一种发红光的荧光标记物到原始生殖细胞的一些基因上,他们可以精确估量出重编程的原始生殖细胞数量。他们的结果显示效率非常之高——多达40%的细胞变为了原始生殖细胞;这一数量使得能够进行简单的分析。
Hanna指出,原始生殖细胞还只是构建出人类精子和卵子的第一步。在实验室能够完成一连串事件,推动成体细胞通过胚胎干细胞周期,变为精子或卵子之前,还面临着许多的障碍。举例来说,在这一过程的某个点,这些细胞必须学会一种特技:在它们变为有活力的生殖细胞之前要将它们的DNA分成两半。不过,他仍然坚信总有一天会克服这些障碍,提高接收化疗或过早绝经的妇女受孕的可能性。
同时,这项研究还生成了一些有趣的结果,有可能会对未来的原始生殖细胞和其他早期胚胎细胞的研究造成重大影响。研究小组设法追踪了引导干细胞分化为原始生殖细胞的一连串遗传事件,他们发现了在人类中(而不在小鼠中)调控这一过程的一个主导基因Sox17。由于这一基因网络完全不同于以往在小鼠中鉴别出的基因网络,研究人员猜测对于在人类中研究这一过程的科学家们而言,等待着他们的或许是更多的惊喜。
Hanna说:“能够在培养皿中构建出人类原始生殖细胞,使得我们能够在分子水平上研究分化过程。例如,我们发现只有‘新鲜’的原始细胞能够变为原始生殖细胞;在常规培养条件下一周后,它们会再度失去这种能力。我们希望能了解其原因。使得它们多一些或少一些潜力的干细胞状态究竟是怎样?在细胞被重编程至更原始的状态后究竟是什么驱动了分化过程?这些基础问题的答案最终将推动iPS细胞技术进入医学应用。”




 400-817-8855
400-817-8855 预约咨询
预约咨询
