Cell:潜在毒性蛋白降解调控新机制
来源:生物360
机体的蛋白质在失去“使用价值”后,它会被细胞降解为氨基酸,然后再循环生成新的蛋白。
近日,洛克菲勒大学霍华德休斯医学研究所(Howard Hughes Medical Institute, The Rockefeller University)的研究人员揭示了细胞的蛋白质回收站——蛋白酶体(proteasome)处理不必要的和潜在毒性蛋白的一条新途径。这一研究发现 对于肌萎缩、神经退行性疾病和癌症等疾病的治疗具有重要的意义。相关论文发表在4月25日的《细胞》(Cell)杂志上。
科学家们一致认为,蛋白酶体持久地处于活跃状态,负责破坏超出寿命期的蛋白质。越来越多的数据表明,蛋白酶体受到动态调控,尤其当细胞面对繁重的蛋白质周转(protein turnover)时会提高它的活性。
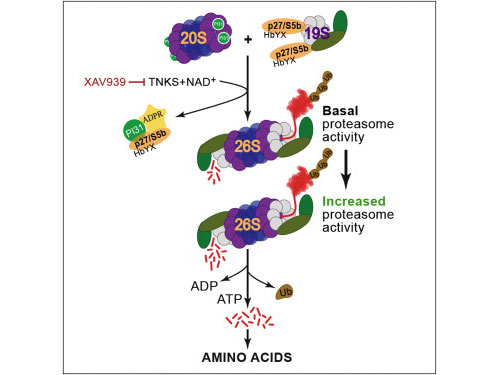
这项最新研究证实一种称作TNKS (ADP-ribosyltransferase tankyrase )的酶调控了蛋白酶体的活性。此外,最初由诺华(Novartis)开发出来治疗结肠癌的一种小分子XAV939可以抑制TNKS,阻断蛋白酶体的活性。
研究人员表示,这项研究发现具有巨大的临床意义,因为它赋予了现有的一种小分子化合物新的价值。尤其是,这种TNKS抑制剂或许可在临床上用于治疗多发性骨髓瘤。
此前,洛克菲勒大学的研究人员在上世纪90年代后期最早鉴别出端锚聚合酶(Tankyrase),证实其在端粒延伸中发挥重要的作用。
在一系列的果蝇和人类细胞实验中,这项最新研究发现端锚聚合酶利用了一个称作ADP核糖基化(ADP-ribosylation)的过程来修饰PI31。 PI31是对蛋白酶体活性,以及将蛋白酶体亚单位组装成称作26s的活性复合体起关键调控作用的一个因子。通过促进组装出更多的26S颗粒,压力下的细胞 可以提高它们分解和处理不必要蛋白质的能力。
蛋白酶体是当前开发癌症治疗的一个靶点。FDA已经批准了蛋白酶体抑制剂万珂(Velcade)用于治疗多发性骨髓瘤和套细胞淋巴瘤。然而,接受Velcade治疗的患者可能会经受周围神经病变,或是产生耐药。
多发性骨髓瘤细胞需要提高蛋白酶体活性才能生存。来自Cho-Park和Steller的初期数据显示,XAV939能够在不影响细胞内蛋白酶体基础水平的情况下,抑制额外的蛋白酶体组装,从而阻断多发性骨髓瘤的生长。这种选择性靶向意味着对患者的副作用较小。
研究人员表示,诸如XAV939这样的药物,通过与Velcade不同的机制来抑制蛋白酶体,具有重要的临床意义。
这项研究结果也是第一次将蛋白酶体的代谢与调控关联起来。有时候,蛋白酶体消化过多的蛋白,有可能导致肌肉减少。蛋白质降解是正常细胞生物学极其重要的一个 过程。新研究发现提供了对于这一过程的基本认识,并揭示了在肌萎缩和神经退变等疾病中的一个重要因子。有趣的是,这些研究发现还启发了正在进行中的癌症治 疗研究,举例说明了基础研究对于药物开发的影响。
原文检索:
Park F. Cho-Park,Hermann Steller. Proteasome Regulation by ADP-Ribosylation. Cell, 25 April 2013; DOI: 10.1016/j.cell.2013.03.040
预约咨询卡
Appointment consultation card




 400-817-8855
400-817-8855 预约咨询
预约咨询
