Cell:邓宏魁与汤超等封面报道细胞重编程过程中的创新方法和理论
来源:生物360

近日,北京大学邓宏魁研究组和汤超研究组合作,首次证明小鼠体细胞重编程可由调控分化的基因完成,并在此基础上提出细胞命运转变的“跷跷板模型”。2013 年5月23日,该成果研究论文“Induction of pluripotency in mouse somatic cells with lineage specifiers”于《细胞》(Cell)期刊以封面文章形式在线发表。《细胞》同期还配发了希伯来大学 Nissim Benvenisty 教授对于该工作的评论文章。
2006年,日本科学家 Shinya Yamanaka 发现向小鼠体细胞转入胚胎干细胞特异因子(OCT4, SOX2, KLF4, c-MYC)可以完成体细胞的重编程。在此之后,细胞重编程领域普遍认为向目标细胞状态的转变需要靠在目标状态中特异高表达的因子的诱导。因此目前发现的 能够在细胞重编程中发挥作用的因子均在胚胎干细胞中高表达并且与细胞干性维持紧密相关。
传统观点认为分化因子与干性因子是相互拮抗,相互抑制的。干性基因在胚胎干细胞中高表达,抑制分化基因;分化基因在胚胎干细胞中不表达或低表达,高表达这些分化因子将抑制干性因子,破坏胚胎干细胞多能性的状态,导致其分化。
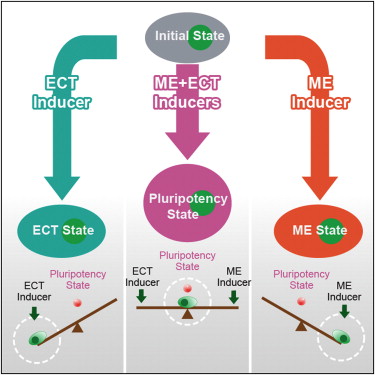
然而邓宏魁研究组通过大规模筛选发现,细胞重编程中至关重要的干性因子OCT4能够被调控中内胚层(ME)发育和分化的因子(如 GATA3,GATA6,PAX1)代替;SOX2能够被调控外胚层(ECT)发育和分化的因子(如GMNN)代替。进一步,汤超研究组根据这一发现创新 性地建立了“跷跷板模型”,来更好的理解中胚层基因和外胚层基因在重编过程中的相互抑制和相互平衡的关系,这种关系可能决定了细胞命运的维持和改变。这个 模型提供了诱导体细胞重编程的其它方法的预测,甚至还有一个出乎意料的模拟结果:如果同时过表达中内胚层和外胚层基因,就可以达到平衡从而同时替代 SOX2和OCT4。而我们的实验结果也进一步证实了这个可能,首次实现了用ME分化因子和ECT分化因子同时替代掉了细胞重编程过程中最关键的两个干性 因子OCT4和SOX2。这一发现改变了向目标细胞状态的转变需要用在目标细胞状态中高表达的因子的诱导的这一传统观点,为研究细胞命运转变提供了新视 角,重新认识了细胞重编程和细胞命运决定的机制。
邓宏魁研究组博士生舒健、吴晨、吴业涛与汤超研究组博士生李志远为共同第一作者,邓宏魁研究组博士后赵扬也在这一工作中发挥了关键作用。邓宏魁、汤超均为北大-清华生命科学联合中心成员。
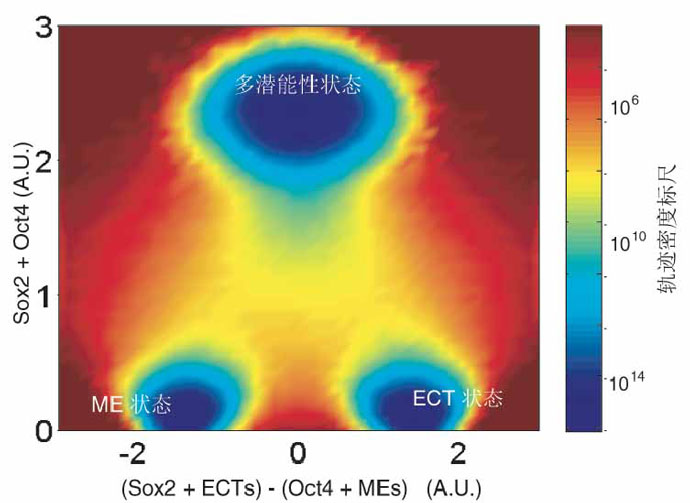
图1.“Seesaw模型”的landscape图
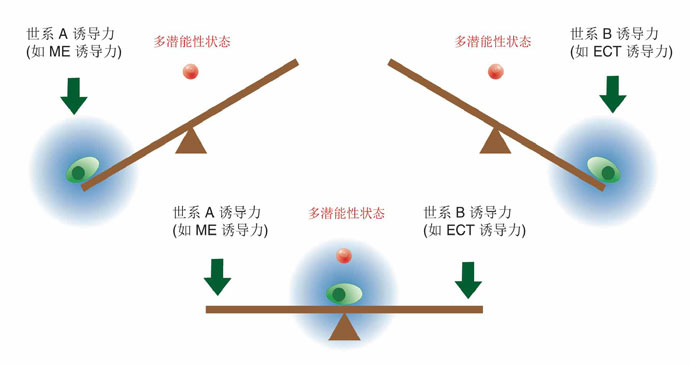
图2. 细胞命运决定的“跷跷板模型”
原文检索:
Jian Shu, Chen Wu, Yetao Wu, Zhiyuan Li, Sida Shao, Wenhui Zhao, Xing Tang, Huan Yang, Lijun Shen, Xiaohan Zuo, Weifeng Yang, Yan Shi, Xiaochun Chi, Hongquan Zhang, Ge Gao, Youmin Shu, Kehu Yuan, Weiwu He, Chao Tang, Yang Zhao, Hongkui Deng. Induction of Pluripotency in Mouse Somatic Cells with Lineage Specifiers. Cell, 23 May 2013; DOI: 10.1016/j.cell.2013.05.001
预约咨询卡
Appointment consultation card




 400-817-8855
400-817-8855 预约咨询
预约咨询
